キラリティーを持つ分子は往々にして中心性キラルであるが、中にはキラル中心がなくともキラリティーを持つ分子がある。
軸性キラリティー (axial chirality)
アレンはπ結合の関係によって、C1とC3を含むそれぞれの平面が互いに直交している。そのためにアレンの誘導体には軸によるキラリティーが存在する。
(例)1-bromo-3-chloroallene

このC=C=Cを通る軸の周りに原子がキラルに配置されているので、この軸をキラル軸と呼ぶ。
ところでこれに対してもR配置、S配置の区別をつけることができる。それには以下の手順を踏む。
1)上図においてそれぞれを矢印の方向から見る(この方向は右からでも左からでも結果は同じである)。
2)視点から見て手前側、奥側でそれぞれ優先順位をつける。
3)手前側の優先順位を上にする。
4)4番目を無視し、1→2→3となる向きに対して仮想的な矢印を描く。
5)矢印の向きが右回り(時計回り)ならR体、左回り(反時計回り)ならS体である。
これをまとめたものが下図となる。

またアレンのように回転が固定されていなくても、回転が阻害されているために軸性キラリティーを持つ分子がある。以下のビフェニル誘導体はそのような分子の例であり、このようにしてできた異性体をアトロプ異性体 (atropisomer)と呼ぶ。
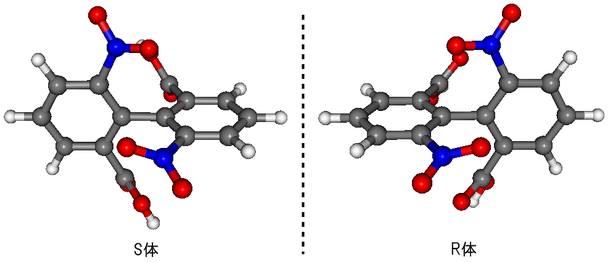
なおこれに対してR、Sの区別をつける手順は先ほどと同じである。N原子の方がC原子よりも原子量が大きいので、優先順位は-COOH<-NO2となることに注意する。
面性キラリティー (planar chirality)
面性キラリティーとは、分子内におけるある面の表と裏の原子配列の違いによって生じるキラリティーである。またそのような面をキラル面と呼ぶ。例えば以下のシクロファン化合物はベンゼン環の表と裏の区別が存在する。
(例)1,11-Dioxa[11]paracyclophane
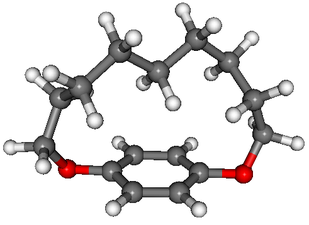
このベンゼン環にある基が置換すれば、化合物に面性キラリティーが発生し、エナンチオマーが生じる。ゆえにこのときのキラル面は、ベンゼン環を含む平面である。
(例)1,11-Dioxa[11]paracyclophaneの置換体

少し複雑だが、R配置、S配置の区別をつける手順は以下の通りである。
1)キラル面内の原子に直結している優先順位の高い原子をパイロット原子とする。
(pilotには案内をするという意味があるので、命名をするという観点からこのような名前になっているのだと思われる)
2)パイロット原子に直結しているキラル面内原子から出発して優先順位の高い原子を辿り、1,2,3と番号をつける。
3)番号をつけた原子が右回り(時計回り)ならばR、左回り(反時計回り)ならばSと命名する。
これを実行した例が上図となる。
また別の例としてtrans-シクロオクテンがある。

らせんキラリティー (helical chirality)
らせん構造を持つ分子は軸性キラリティーを持った特殊な化合物と見ることができるが、特別にらせんキラリティー(helical chirality)あるいはヘリシティー(helicity)と呼ぶ。典型的な例がヘリセン(helicene)であり、以下にはヘキサヘリセンの構造を示す。なお立体配置はR,SではなくP(plus),M(minus)で表す。プラスが右ネジの向き、マイナスがその反対向きである。

(ところで「らせん(helix)」というとタンパク質の二次構造であるヘリックスが思い返される。ヘリックスは大概が右回りである。)
コメントをお書きください